近日,骞爱荣教授团队在国际著名骨科期刊《Bone》在线发表了最新研究成果“MACF1 promotes osteoblastic cell migration via regulating MAP1B through the GSK3β/TCF7 pathway”,报道了成骨系细胞迁移对骨形成的作用及骨质疏松发生的新机制[1]。

骨形成是维持骨量和骨骼健康的重要生理过程。该过程由间充质干细胞(MSCs)分化而来的成骨系细胞来完成[2]。在膜内骨化过程中,MSCs首先被募集到骨表面,进行增殖和分化,最终成为成熟的成骨细胞[3]。 因此,成骨系细胞迁移是骨形成过程中一个重要的生理过程。成骨系细胞迁移的异常将导致骨骼疾病的发生,例如骨质疏松症和骨折延迟愈合。
微管肌动蛋白交联因子1 (MACF1)是血影蛋白家族的成员,通过其F-肌动蛋白和微管蛋白结合域与肌动蛋白和MT结合。MACF1在众多组织中普遍表达,并在许多生理和病理过程中发挥重要作用[4]。细胞迁移的调节是MACF1最重要的功能之一,该功能由Wu等人于2008年首次报道[5,6]。
在本研究中,作者发现了MACF1缺失抑制成骨系细胞MC3T3-E1和皮质骨来源间充质干细胞(C-MSC)的迁移,并降低细胞微管骨架稳定性(图1)。
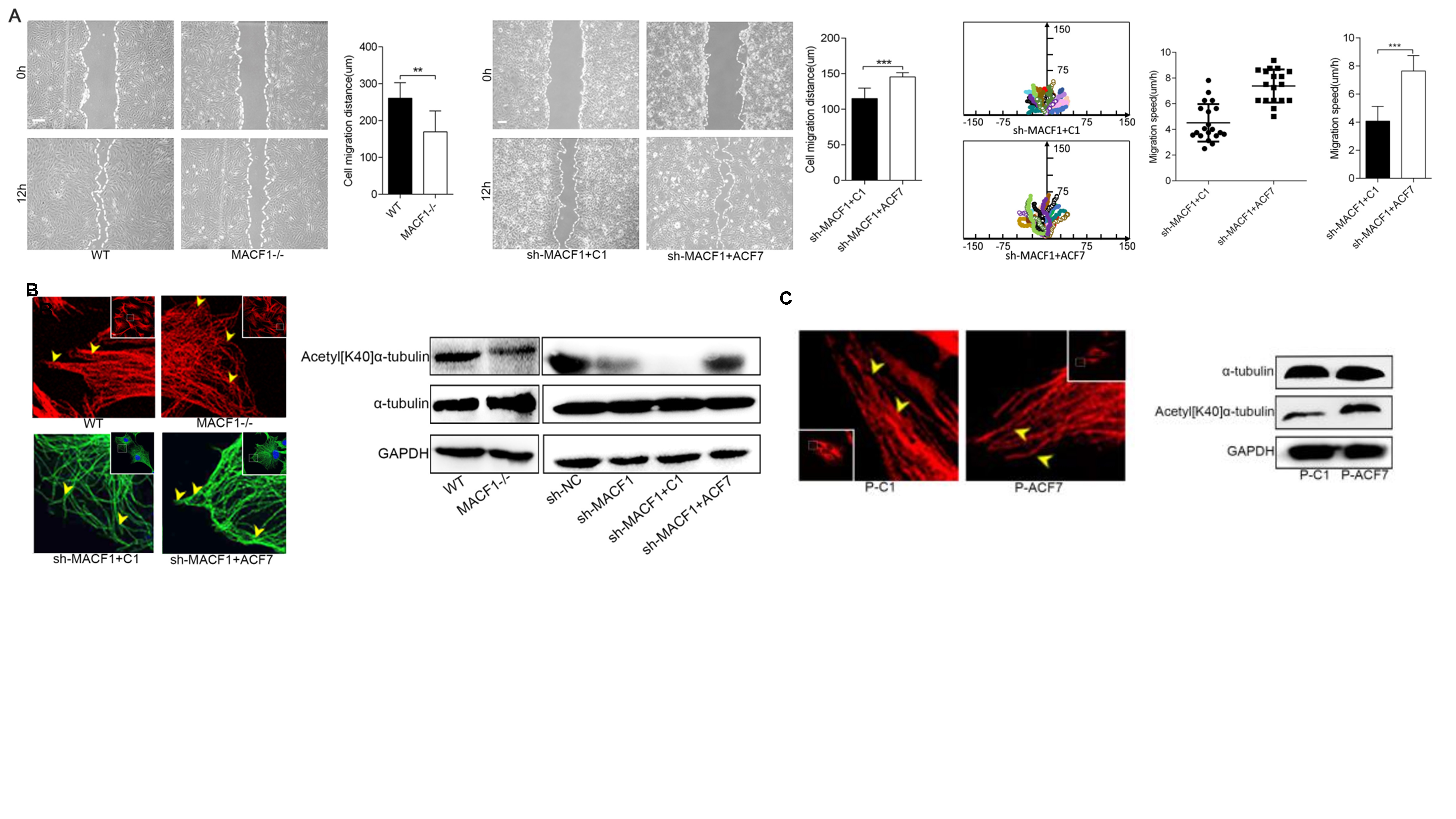
图1. MACF1提高微管骨架稳定性,促进成骨系细胞迁移(原文Fig 1和Fig S1)。
MAP1B在维持微管骨架稳定性和调控细胞迁移方面具有重要的作用。作者发现,在MACF1缺失细胞中,MAP1B的表达量也显著下降;利用siMAP1B转染细胞之后发现,MAP1B基因的沉默显著抑制了成骨系细胞的迁移,细胞微管骨架纤维也变的紊乱,成断裂不连续的状态,这与MACF1缺失细胞的表型非常相似(图2)。
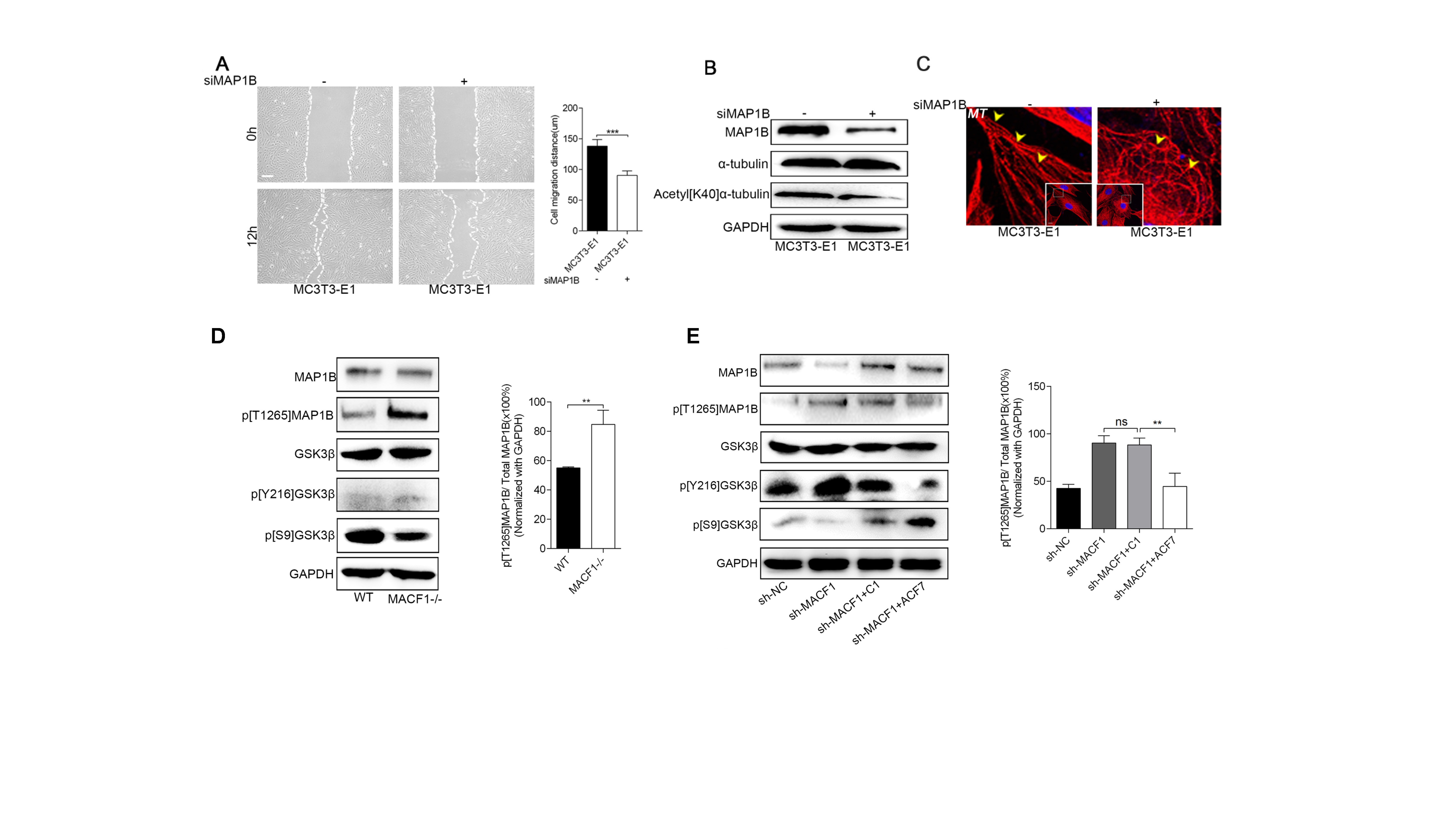
图2 MACF1通过MAP1B调控成骨系细胞迁移和微管骨架稳定性(原文Fig 2和Fig 3)。
MAP1B的1265位酪氨酸可被GSK3β磷酸化,磷酸化的MAP1B(p[T1256]MAP1B)降低微管蛋白α-tubulin的乙酰化水平,降低微管骨架稳定性。作者发现,MACF1缺失上调p[T1256]MAP1B水平,下调乙酰化α-tubulin(Acetyl[K40]α-tbulin)的水平,降低微管骨架稳定性,最终抑制成骨系细胞迁移(图3)。
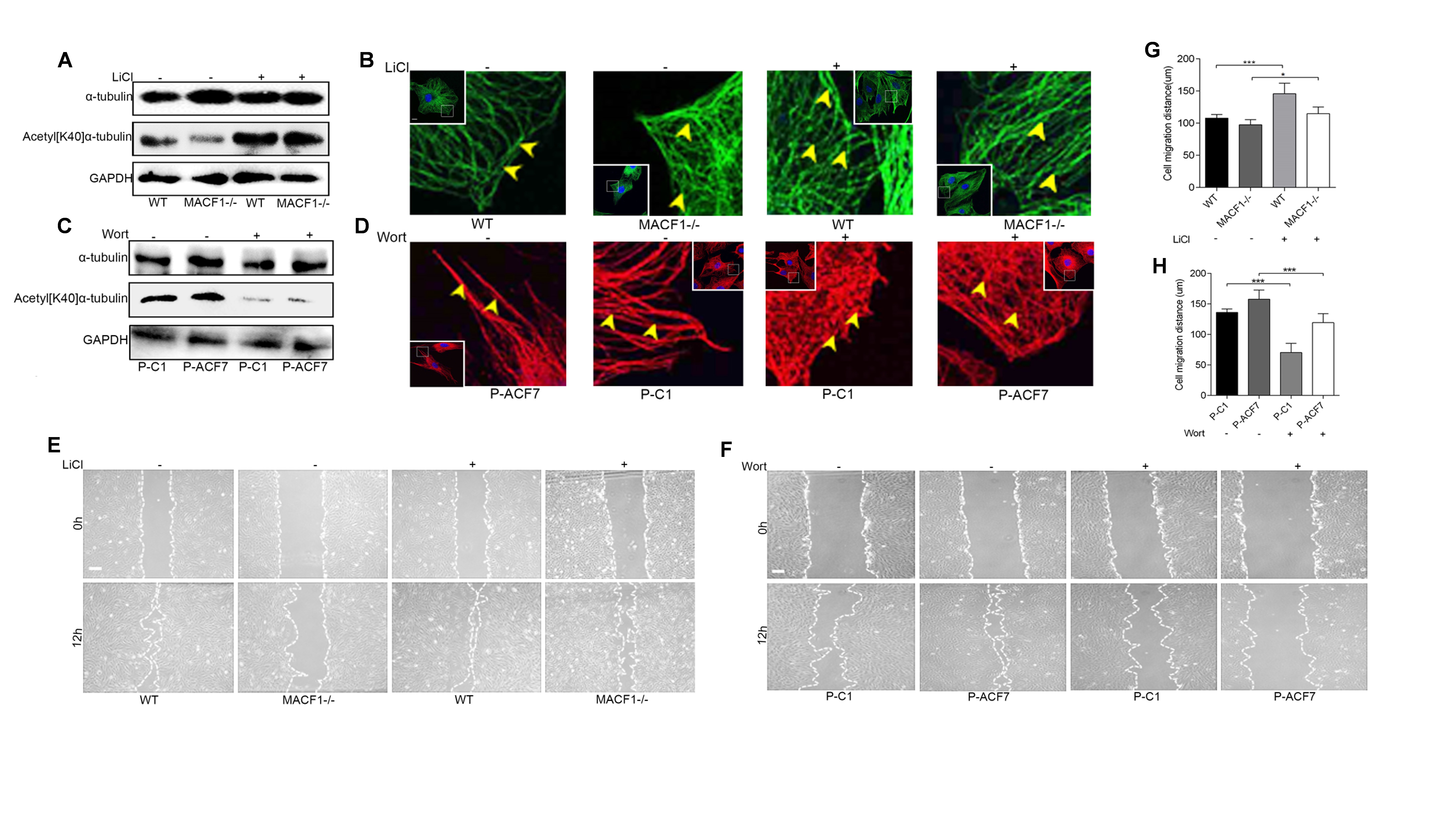
图3 MACF1通过GSK3β调控MAP1B磷酸化和成骨系细胞迁移(原文Fig3)。
除此之外,作者发现MACF1缺失导致MAP1B mRNA表达水平下降;利用JASPAR在线软件预测发现转录因子TCF7可以结合MAP1B基因的启动子区DNA序列;利用荧光素酶报告基因和染色质免疫共沉淀技术发现MACF1促进TCF7与MAP1B基因启动子区的结合进而促进MAP1B的表达(图4)。
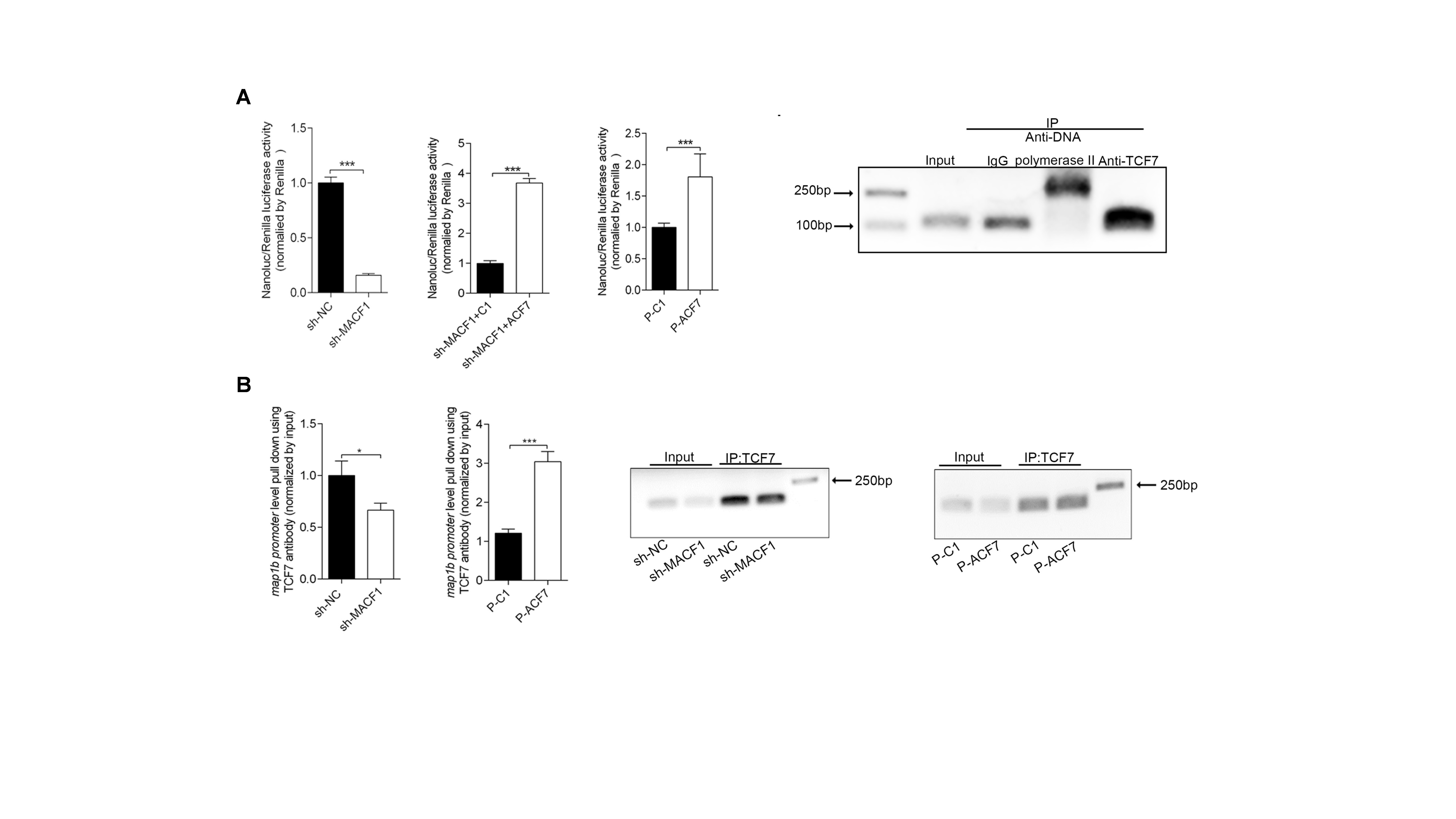
图4 MACF1通过促进TCF7在MAP1B基因启动子区的结合促进MAP1B mRNA的表达 (原文Fig 4)。
总之以上结果阐明了MACF1在调控成骨系细胞迁移和骨形成中的重要功能和机制,为进一步研究MACF1在骨代谢和骨骼相关疾病的治疗提供了潜在靶点。(文/图:苏佩红;审核:杨慧)
参考文献:
[1] Su P, Ye T, Yin C, et al. MACF1 promotes osteoblastic cell migration by regulating MAP1B through the GSK3beta/TCF7 pathway. Bone. 154 (2021),http://doi.org/10.1016/j.bone.2021.116238.
原文链接:https://www.sciencedirect.com/science/article/abs/pii/S875632822100404X?via%3Dihub
[2] Luu HH, Song WX, Luo X, et al. Distinct roles of bone morphogenetic proteins in osteogenic differentiation of mesenchymal stem cells. Journal of orthopaedic research: official publication of the Orthopaedic Research Society. 25 (2007) 665-77,https://doi.org/10.1016/j.gendis.2019.03.008.
[3] Su P, Tian Y, Yang C, et al. Mesenchymal Stem Cell Migration during Bone Formation and Bone Diseases Therapy. Int J Mol Sci. 19 (2018),https://doi.org/10.3390/ijms19082343.
[4]Bernier G, Mathieu M, De Repentigny Y, et al. Cloning and characterization of mouse ACF7, a novel member of the dystonin subfamily of actin binding proteins. Genomics. 38 (1996) 19-29,https://doi.org/10.1006/geno.1996.0587.
[5] Wu X, Kodama A, Fuchs E. ACF7 regulates cytoskeletal-focal adhesion dynamics and migration and has ATPase activity. Cell. 135 (2008) 137-48,https://doi.org/10.1016/j.cell.2008.07.045.
[6] Wu X, Shen QT, Oristian DS, et al. Skin stem cells orchestrate directional migration by regulating microtubule-ACF7 connections through GSK3beta. Cell. 144 (2011) 341-52,https://doi.org/10.1016/j.cell.2010.12.033.